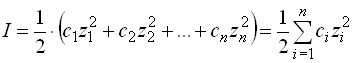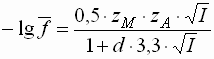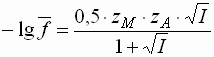Aktivität und Ionenstärke
Grundlagen
- Starke Elektrolyte sind in wässriger Lösung, auch bei höheren Konzentrationen, praktisch vollständig in Ionen dissoziiert. (Debye, Hückel, 1913)
- Die verschieden geladenen Ionen beeinflussen sie sich jedoch gegenseitig. So bilden sich um Anionen Ansammlungen von Kationen und umgekehrt.
- Mit steigender Konzentration des Elektrolyten in der Lösung nimmt dieser Effekt zu.
- Um den Effekt der Wechselwirkung der Ionen im Massenwirkungsgesetz zu berücksichtigen, der sich dadurch auswirkt, dass die scheinbare Anzahl dissoziierter Teilchen verringert ist, wird ein Korrekturfaktor eingeführt.
Aktivität
- Dieser Korrekturfaktor, bezeichnet als Aktivitätskoeffizient f, wird mit der Stoffmengenkonzentration c multipliziert und ergibt so die "effektive Konzentration", die Aktivität a.
a : Aktivität [mol/l] f : Aktivitätskoeffizient [1] c : Stoffmengenkonzentration [mol/l]
- Der Aktivitätskoeffizient f muss experimentell ermittelt werden.
- Dabei ist jedoch nur der mittlere Aktivitätskoeffizient messbar. Dieser ist nicht allein abhängig von der Konzentration der eigenen Ionen, sondern vielmehr von der Konzentration aller in der Lösung vorhandenen Ionen.
Ionenstärke
- Die Gesamtwirkung aller in der Lösung vorhandenen Ionen wird mit Hilfe der, von Lewis eingeführten, Ionenstärke I ausgedrückt.
- In verdünnten Lösungen (I < 0,02 mol/l) wird der mittlere Aktivitätskoeffizient allein von der Ionenladung und der Ionenstärke bestimmt:
- Im mittleren Konzentrationsbereich (0,02 mol/l < I < 0,25 mol/l) muss bei der Berechnung des Aktivitätskoeffizienten von wässrigen Lösungen, zusätzlich der wirksame Durchmesser der Ionen berücksichtigt werden. Der Aktivitätskoeffizient wird somit auch von den stofflichen Eigenschaften der Ionen abhängig:
- Beide Formeln lassen sich in einer Näherung zusammenfassen: