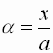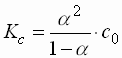Dissoziationskonstante und Dissoziationsgrad
Bemerkungen
- Schwache Elektrolyten liegen in einer wässrigen Lösung nur teilweise in Ionen dissoziiert vor.
- Die Dissoziation ist eine Gleichgewichtsreaktion, so dass sich auch für sie über das Massenwirkungsgesetz eine Gleichgewichtskonstante, hier als Dissoziationskonstante Kc bezeichnet, berechnen lässt.
- Der Dissoziationsgrad a ist definiert als Quotient der Stoffmenge x in Mol, die in Ionen dissoziiert vorliegt, zur gesamten gelösten Stoffmenge a in Mol.
a : Dissoziationsgrad [1] x : In Ionen dissoziierte Stoffmenge [mol] a : Gesamtstoffmenge [mol]
- Das Ostwaldsche Verdünnungsgesetz (entdeckt 1889) beschreibt das Verhältnis zwischen Dissoziationsgrad a und Dissoziationskonstante Kc. Es lautet:
Kc : Dissoziationskonstante [mol] a : Dissoziationsgrad [1] c0 : Ausgangskonzentration [mol]
- Verdünnt man eine Lösung eines schwachen Elektrolyten, oder erhöht man die Temperatur, so nimmt der Dissoziationsgrad a zu. Bei unendlicher Verdünnung nähert er sich dem Wert 1.