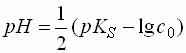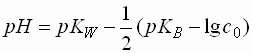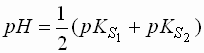Salzlösungen
Bemerkungen
- Löst man ein Salze in Wasser, so zerfällt ihr Ionengitter. Anionen und Kationen befinden sich frei in der Lösung. In vielen Fällen geschieht nun, von der Hydratation abgesehen, nichts mehr. Es kann jedoch auch zu einer Veränderung des pH-Wertes der Lösung durch die Ionen des Salzes kommen, wenn diese mit den Wassermolekülen in Protolysereaktionen reagieren.
Salze sehr starker Säuren und sehr starker Basen (pK bis ca. 1)
- Bei Salzen diese Typs kommt es nach Auflösen in Wasser nur zur Hydratation. Eine weitere Protolyse findet nicht statt, so dass der pH-Wert unverändert bei pH 7 bleibt.
- Beispiel:
NaCl + H2O ----> Na+ + Cl- + H2O
Salze sehr starker Säuren und schwacher Basen (pKB > 4,5)
- Bei diesen Salzen geht das Kation eine Protolysereaktion mit dem Wasser ein.
- Beispiel:
NH4Cl + H2O ----> NH3 + Cl- + H3O+
- Der pH-Wert der Lösung sinkt demzufolge ab.
- Das Dissoziationsgleichgewicht entspricht dem einer schwachen Säure.
- Der genaue pH-Wert berechnet sich als:
Salze schwacher Säuren (pKS > 4,5) und sehr starker Basen
- Hier geht nur das Anion eine Protolysereaktion mit Wasser ein.
- Beispiel:
KCN + H2O ----> K+ + HCN + OH-
- Der pH-Wert steigt also an.
- Das Dissoziationsgleichgewicht entspricht dem einer schwachen Base, daher erfolgt die Berechnung des pH-Wertes der Lösung dazu analog:
Salze schwacher Basen und schwacher Säuren (pK > 4,5)
- Sowohl das Anion, als auch das Kation, gehen eine Protolysereaktion mit den vorhandenen Wassermolekülen ein.
- Beispiel NH4CN:
NH4+ + H2O ----> NH3 + H3O+ und CN- + H2O ----> HCN + OH-
- Welche der Protolysereaktionen überwiegt hängt von den pKS-Werten der Säuren ab.
- Für den pH-Wert der Lösung ergibt sich:
- Der pH-Wert ist nahezu unabhängig von der Konzentration des Salzes in der Lösung.