Chromat und Dichromat
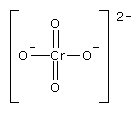
Strukturformel (Chromat)
Summenformel (Chromat)
CrO42-
Bemerkungen
- Chromat liegt so praktisch nur in Lösungen mit einem pH-Wert von über 8 vor. Im pH-Bereich von 2 bis 6 liegt es in sehr verdünnten Lösungen als HCrO4-, darunter als H2CrO4 vor. Meist kondensiert Chromat im sauren pH-Bereich jedoch zu Dichromat.
- Dabei laufen folgende pH-abhängige,
reversible Gleichgewichtsreaktionen ab:
CrO42- + H+ ----> HCrO4-
2 HCrO4- ----> Cr2O72- + H2O
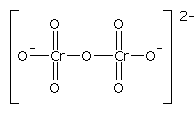
Strukturformel (Dichromat)
Summenformel (Dichromat)
Cr2O72-
Nachweis
Als CrO(O2)2
Cr2O72- + 4 H2O2 + 2 H+ ----> 2 CrO(O2)2 + 5 H2O
4 CrO(O2)2 + 12 H+ ----> 4 Cr3+ + 6 H2O + 7 O2
- Dichromat bildet in salpeter- oder schwefelsaurer Lösung mit Wasserstoffperoxid in der Kälte blaues Chromperoxid, das mit Ether oder Amylalkohol ausgeschüttelt werden kann. Die Verbindung wird durch den Ether gleichzeitig stabilisiert.
- Nach einiger Zeit schlägt die blau Farbe in Grün oder Violett um, da Chrom(III) entsteht.
Als AgCrO4
CrO42- + 2 Ag+ ----> Ag2CrO4
- Ein Tropfen der salpetersauren Probe wird mit einem Tropfen 1 molarer AgNO3-Lösung versetzt und mit Ammoniak bis zur schwach sauren Reaktion abgestumpft. Bereits dabei fallen meist große blutrote Kristalle aus Silberchromat aus.
- Bei sehr geringen Chromatmengen wird ein AgNO3-Kristall zugesetzt.
- Die Reaktion ist sehr empfindlich und spezifisch.
- Die Probelösung darf nicht neutral oder zu stark sauer sein.
- Größere Mengen Alkali- und Erdalkalisalze stören die Kristallisation.