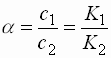Nernstsches Verteilungsgesetz
Formel
a : Verteilungskoeffizient c1 : Konzentration der ersten Lösung c2 : Konzentration der zweiten Lösung K1 : Löslichkeitskonstante im Lösemittel 1 K2 : Löslichkeitskonstante im Lösemittel 2
Herleitung
- Das Nernstsche Verteilungsgesetz (1891) leitet sich aus dem Gesetz von William Henry aus dem Jahr 1803 ab. Danach ist die Löslichkeit eines Gases in einer Flüssigkeit bei gegebener Temperatur im Gleichgewicht proportional zu seinem Druck.
- Steht dieser Stoff gleichzeitig in Verbindung mit zwei Lösungsmitteln, so stellt sich zwischen beiden und dem Gas ein Gleichgewicht ein unter Ausbildung verschiedener Konzentrationen in den einzelnen Lösungsmitteln.
- Da der Druck des Gases in beiden Fällen gleich ist, stellt sich das obige Verhältnis ein.
Bemerkungen
- Das Nernstsche Verteilungsgesetz ist die theoretische Erklärung für das Funktionieren der Extraktion eines Stoffes aus einem Lösemittel durch ein anderes, in dem der Stoff besser löslich ist.
- Da die Lage des Gleichgewichts immer Konstant bleiben muss, kann man durch mehrfache Extraktion die Konzentration des Stoffes in der Ausgangslösung praktisch gegen 0 senken. Bei einer 10mal so guten Löslichkeit in Lösemittel 2 werden immer 90 % der in der Ausgangslösung enthaltenen Stoffmenge in Lösemittel 2 überführt, unabhängig von der absoluten Konzentration des Stoffs in der Ausgangslösung.
- Daher ergibt die mehrfache Extraktion mit kleinen Teilvolumen der Gesamtmenge des Lösemittels ein besseres Ergebnis als die einmalige Extraktion mit dem gesamten Volumen auf einmal.