Allgemeine Gasgleichung
Formel
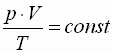
| p |
: |
Druck |
| V |
: |
Volumen |
| T |
: |
absolute
Temperatur |
Bemerkungen
- Das allgemeine Gasgesetz gilt für ideale
Gase.
- Bezieht man diese Gleichung auf eine
bestimmte Masse eines Gases, so ergibt sich aus obiger Formel:
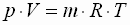
| p |
: |
Druck |
| V |
: |
Volumen |
| m |
: |
Masse |
| R |
: |
spezielle Gaskonstante |
| T |
: |
absolute Temperatur |
- Die spezielle Gaskonstante ist eine
stoffabhängige Größe, da verschiedene Gase bei gleicher Masse
unterschiedlich viele Moleküle enthalten.
- Bezieht man die allgemeine Gasgleichung
statt auf die Masse auf die Teilchenanzahl (in Mol), so erhält man einen
von der Art des betrachteten Gases unabhängigen Wert, die sogenannte
allgemeine Gaskonstante:
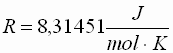
- Für n Mole eines idealen Gases ergibt sich
somit:
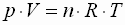
- Statt auf das Mol kann man die allgemeine
Gasgleichung auch auf das Molekül beziehen. Sei N die Anzahl der Moleküle
im betrachteten Gas und NA die Zahl der Moleküle pro Mol (Avogadro-Konstante),
so gilt:
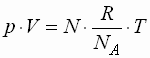
|
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Demoversion des
pharm@zie-Projektes
vom 27.12.2001. Für den Zugriff auf die aktuelle Online-Version
benötigen Sie ein
persönliches Passwort.
Auch wenn diese Altversion einer Spende eigentlich nicht würdig ist, würde
ich mich natürlich darüber freuen, um die aktuelle Version werbefrei und so
unabhängig wie mir möglich zu halten. Fachliche Unterstützung wäre mir
jedoch noch viel lieber als Geld...
Die Übernahme der Texte und
Bilder in andere On- oder Offline-Angebote ist nur mit schriftlicher
Erlaubnis gestattet!
Datenschutz
|
Impressum
|
© 2000 - 2018
www.BDsoft.de |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
|