Katalysator
Definition
- Katalysatoren sind Substanzen, die die Einstellung des Gleichgewichts bei einer chemischen Reaktion beschleunigen,
ohne dabei selbst verbraucht zu werden oder die Lage des Gleichgewichts selbst zu verschieben.
Bemerkungen
- Tritt der Katalysator im System der Reaktionspartner in der gleichen Phase auf, spricht man von homogener Katalyse. Treten Katalysator und Reaktanden in unterschiedlichen Phasen auf, spricht man von heterogener Katalyse.
- In den meisten Fällen wird die Einstellung des Gleichgewichts dadurch behindert, dass eine hohe Aktivierungsenergie
überwunden werden muss. Zwischen Edukten und Produkten liegt dabei ein energetisch sehr ungünstiger (energiereicher) Übergangszustand, der bei der Reaktion überwunden werden muss. Katalysatoren vermögen die erforderliche Aktivierungsenergie zu
senken, indem sie energieärmere Übergangszustände ermöglichen. Dadurch wird die Wahrscheinlichkeit, dass die entsprechenden Eduktmoleküle bei einer Kollision energiereich genug sind, den Übergangszustand zu überwinden und zum Produkt zu
reagieren, erhöht - die Einstellung des Gleichgewichts wird beschleunigt.
- Der genaue Mechanismus, mit dem Katalysatoren in die Reaktion eingreifen ist in vielen Fällen noch völlig ungeklärt.
- Als mögliche Reaktionswege nimmt man bei der homogenen Katalyse die Bildung aktivierter Komplexe aus den Edukten und dem Katalysator in Form eines nicht isolierbaren Zwischenprodukts an, bei der heterogenen Katalyse
die Lockerung von Bindungen in den Edukten durch deren Adsorption an der Katalysatoroberfläche.
- Oftmals lässt sich durch Wahl eines geeigneten Katalysators das Produkt relativ frei von Nebenprodukten erzeugen, da Katalysatoren in vielen Fällen sehr sehr selektiv reagieren.
- Katalysatoren besitzen nicht nur in der Chemie eine große Bedeutung, sondern sich auch an einer großen Zahl wichtiger biologischer Lebensvorgänge beteiligt.
- Das Gegenteil eines Katalysators ist ein Inhibitor.
Inhibitoren sind Stoffe, die die Einstellung des Gleichgewichts einer Reaktion verlangsamen bis praktisch verhindern.
Trivialnamen
- Für einige Katalysatoren gibt es leider auch wieder Trivialnamen, die jedoch glücklicherweise nicht besonders oft gebraucht werden:
-
Adams
-Katalysator
- Platin-Katalysator zur Hydrierung
- Der Kat wird meist in situ hergestellt: PtO2 + 2 H2 --> Pt + H2O
- Platin gilt als der reaktivste Katalysator zur Hydrierung
-
Sabather
-Katalysator
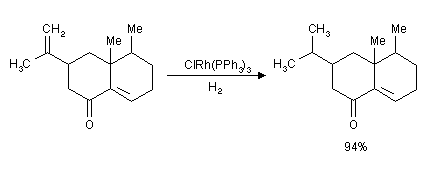
- Wilkinson
-Katalysator
- Chlor-tris(triphenylphosphin)-rhodium(I):
ClRh(PPh3)3
- Homogener Katalysator zur Hydrierung bei Normaldruck.
- Der Katalysator ist selektiv für endständige
Doppelbindungen:
|

