Antikörper (Immunglobuline)
Aufbau / Bemerkungen
- Antikörper, auch als Immunglobuline bezeichnet, bestehen chemisch aus mindestens vier Polypeptidketten:
- zwei identischen H-Ketten (heavy = schwer) und
- zwei identischen L-Ketten (light = leicht).
- Die Ketten sind untereinander mit Disulfidbrücken
verbunden und weisen insgesamt die Form eines Y auf.
- Es gibt fünf unterschiedliche H-Ketten, nach denen die Immunglobuline in die entsprechenden Klassen unterteilt
werden (γ -,
m -,
a -,
e - und
d - Ketten) sowie zwei verschiedene L-Ketten
(κ- und
λ-Ketten), die in
allen fünf Klassen der Immunglobuline vorkommen.
- Mit Hilfe bestimmter Enzyme kann man Immunglobuline aufspalten, es entstehen dabei zwei
Fab-Fragmente (antigenbindend) und das immunologisch nichtspezifische
Fc-Stück.
- Das Fab-Fragment wird auch als Paratop
bezeichnet.
- Die antigenspezifischen Bindungsstellen befinden sich am
äußeren Ende der beiden Fab-Fragmente und sind auf dem Bild
dunkel abgesetzt:
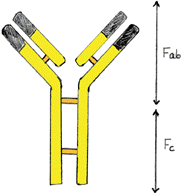
- Ein Immunglobulin hat üblicherweise zwei Fab-Fragmente mit zwei identischen Antigenbindungsstellen, es ist
bivalent und kann daher zwei identische antigene Strukturen binden.
- Die antigenspezifischen Bindungsstellen bestehen
aus variablen Aminosäuresequenzen, weshalb sie auch als V-Region
bezeichnet werden.
- Im Organismus können praktisch gegen jedes Antigen
ein spezifischer Antikörper gebaut werden.
- Das Fc-Stück eines Immunglobulins ist
unveränderlich, es gehört mit den Fab-Stücken zur
sogenannten C-Region.
- Am Fc-Teil können keine Antigene gebunden werden,
dennoch ist dieses Endstück von großer Bedeutung: Es ist die
Bindungsstelle für humorale
Faktoren und Zellmembranen, so z.B. für die erste Komplementkomponente oder für
Makrophagen.
Klassen
- Den verschiedenen H-Ketten entsprechend, werden fünf Klassen von Immunglobulinen
eingeteilt:
|

