Säure-Base-Titrationen
Definition
- Es werden sauer reagierende Stoffe mit Basen bestimmt
(Alkalimetrie), bzw. basisch reagierende Stoffe mit Säuren bestimmt (Acidimetrie).
Auswertung
- Konduktometrisch
- Potentiometrisch
- Das Potential wird zwischen einer
pH-sensitiven Indikatorelektrode
und einer Bezugselektrode
gemessen.
- Bei Verwendung der
Standardwasserstoffelektrode als Indikatorelektrode und einer SSE als
Bezugselektrode ergibt sich folgende Berechnung des pH-Wertes der
Lösung:
- Im Beispiel wird von einer
gemessenen elektromotorischen Kraft von +357 mV ausgegangen. Das
Potential einer SSE
beträgt +208 mV. Da
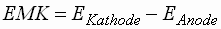 gilt, muss die Wasserstoffelektrode die Anode sein und die SSE die
Kathode. Das Potential der Anode ergibt sich nun zu +148 mV. Dieses
ergibt eingesetzt in die Nernst-Gleichung
(hier in der Form
gilt, muss die Wasserstoffelektrode die Anode sein und die SSE die
Kathode. Das Potential der Anode ergibt sich nun zu +148 mV. Dieses
ergibt eingesetzt in die Nernst-Gleichung
(hier in der Form 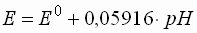 )
einen pH-Wert der Lösung von 2,5. )
einen pH-Wert der Lösung von 2,5.
- Visuell
Bemerkungen
- Säuren mit einem pKS-Wert über 4 weisen bei t = 0,5 einen Pufferpunkt auf. An diesem gilt pKS = pH.
Anwendungsbeschränkungen
- In Wasser sind, wegen der Autoprotolyse, Säuren nur bis zu einem pKS-Wert von 8 titrierbar.
|
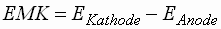 gilt, muss die Wasserstoffelektrode die Anode sein und die SSE die
Kathode. Das Potential der Anode ergibt sich nun zu +148 mV. Dieses
ergibt eingesetzt in die Nernst-Gleichung
(hier in der Form
gilt, muss die Wasserstoffelektrode die Anode sein und die SSE die
Kathode. Das Potential der Anode ergibt sich nun zu +148 mV. Dieses
ergibt eingesetzt in die Nernst-Gleichung
(hier in der Form 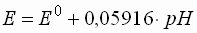 )
einen pH-Wert der Lösung von 2,5.
)
einen pH-Wert der Lösung von 2,5.