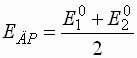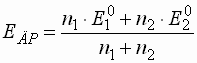Redoxtitrationen
Definition
Auswertung / Bemerkungen
- Amperometrisch
- Potentiometrisch
- Über eine Ableitelektrode (Redox-Elektrode)
wird das Redoxpotential gegenüber einer Bezugselektrode
gemessen.
- Grundsätzlich genügt es, wenn die Ableitelektrode auf eines der
beiden beteiligten Systeme anspricht. Falls keines der beiden an der
Titration beteiligten Systeme elektrochemisch aktiv ist, so kann evtl.
eine Rücktitration mit einem elektrochemisch aktiven System
durchgeführt und potentiometrisch vermessen werden.
- Titriert man Reduktionsmittel mit einem Oxidationsmittel, so steigt
das gemessene Potential während der Titration an, werden
Oxidationsmittel mit Reduktionsmitteln titriert, so sinkt das zu
messende Potential im Laufe der Titration.
- Das Phasendiagramm einer Redoxtitration lautet z.B.:
- Pt | Fe2+, Fe3+, Ce3+, Ce4+
|| Cl-, AgCl | Ag
- Das Potential der Lösung am Äquivalenzpunkt entspricht bei
valenzsymmetrischen Redoxsystemen dem Mittelwert der Standardpotentiale
des betrachteten Redoxsystems.
- Bei t = 0,5 entspricht das gemessene Potential dem Normalpotential des
zu bestimmenden Redoxsystems.
- Ebenso wie bei Säure-Base-
oder Fällungstitrationen treten
bei Redoxtitrationen im Bereich des Äquivalenzpunktes
scharfe Potentialsprünge auf, die eine potentiometrische Indizierung
gestatten.
- Die Äquivalenzpunkte bei valenzasymmetrischen Titrationen liegen
nicht in der Mitte der potentiometrischen Stufe. Das
Äquivalenzpotential stimmt auch nicht mit dem Punkt größter Steilheit
überein. Das Potential am Äquivalenzpunkt ergibt sich zu:
- Visuell
|