Elektrophorese
Definition
- Als Elektrophorese bezeichnet man die Wanderung von geladenen Teilchen unter dem Einfluss eines elektrischen Feldes. Die Teilchen befinden sich in Lösung und liegen in dispergierter oder kolloidal gelöster Form vor.
Elektrophoretische Bewegung
- Die sich einstellende Geschwindigkeit der zu trennenden Teilchen während der Trennung ist von der beschleunigenden Kraft durch das elektrische Feld und die Reibung der Teilchen abhängig.
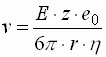
v : Wanderungsgeschwindigkeit E : Elektrische Feldstärke z : Ladungszahl e0 : Elementarladung r : Teilchenradius h : Viskosität
- FORMEL
- Um die Konvektion als verfälschende Größe gering zu halten, muss u.U. gekühlt werden.
- Für die entstehende Wärme gilt
- FORMEL
- Andere Verfahren zur Unterdrückung der Konvektion sind die Gelelektrophorese und die Kapillarelektrophorese.
....
- Die Ionenstärke dient oft als Maß für den Elektrolytanteil in einer Lösung.
....
- Die Ionenbeweglichkeit von schwachen Säuren und Basen ist eine Funktion des Dissoziationsgrades und damit auch des pH-Wertes.
....
Die chemische Zusammensetzung des Mediums bestimmt dessen restriktive Wirkung.
Unter restriktiver Wirkung versteht man die Behinderung der Wanderung von Teilchen. Durch die Struktur des Trägers können die Teilchen nicht mehr auf dem kürzesten Weg zur Elektrode wandern. Durch Variation der Porengröße (Gele) kann ein zusätzlicher Molekularsiebeffekt auftreten.
Einsatzgebiete
- Elektrophoretisch getrennt werden können
- kleine Ionen mit definierter Ladung, anorganische Ionen
- DNA / RNA, Nukleinsäuren, Nukleotide
- Carbonsäuren, Sulfonsäuren, Phenole, Amine
- Immunglobuline, Proteine
- Neutralstoffe mit CE, z.B. unter Zusatz anionischer Tenside
Träger
- trägerlose Elektrophorese
- Die Wanderung der Teilchen erfolgt direkt in der Pufferlösung. Negative Effekte wie Diffusion und Konvektion wirken sich hier besonders aus.
- Beispiel: Free-Flow-Elektrophorese
- Bei der Variante der Kapillarzonenelektrophorese sind Diffusion und Konvektion deutlich gemindert.
- trägergestützte Elektrophorese
- Trägermaterial sind meist Gele (Gelelektrophorese) sowie puffergetränkte Filterpapiere (Papierelektrophorese) und Celluloseacetatfolien.
- Große Bedeutung kommt der Gelelektrophorese zu. Hier kann die Trennung zusätzlich über die Porengröße beeinflusst werden. Zur Verfügung stehen Agarose-, Polyacrylamid- und Stärkegele.
- Agarosegele besitzen relativ große Gelporen und eignen sich aus diesem Grund besonders zur Trennung großer Moleküle wie DNA oder RNA.
- Polyacrylamidgele
können mit ihrer mittleren Porengröße gezielt und reproduzierbar hergestellt werden. Damit ist eine Anpassung an das individuelle Trennproblem möglich. Polyacrylamidgele liefern gut reproduzierbare Ergebnisse. Sie bestehen aus:
- Acrylamid
- Polymermatrix, Porengröße
- Bisacrylamid
- Quervernetzung, Porengröße
- TEMED (N,N,N',N'-Tetramethylethylendiamin)
- Ammoniumpersulfat
- Radikalstarter
- Riboflavin
- Radikalstarter, mit schlechteren Ausbeuten
- Pufferlösung
- gewünschter / erforderlicher pH-Wert
- Saccharose
- Viskositätserhöhung, Feuchthaltemittel
- Acrylamid
Trennprinzipien
- Zonenelektrophorese
- Hierzu zählen trägerfreie und trägergestützte Methoden, bei denen die Trennung in einem einheitlichen Grundelektrolyten erfolgt (pH und elektrische Feldstärke sind im gesamten Trennbereich gleich).
- Meist ist der Grundelektrolyt eine Pufferlösung, die fast den gesamten Stromtransport übernimmt.
- Die Trennung erfolgt über die Ladungsdichte (Verhältnis Ladung / Größe).
- Probenbestandteile mit unterschiedlichen Ionenbeweglichkeiten wandern mit unterschiedlicher Geschwindigkeit.
- Isotachophorese
- Hierbei liegt ein diskontinuierliches Elektrolytsystem vor. Es besteht aus einem Leit-Ion mit einer hohen Ionenbeweglichkeit und einem Folge-Ion mit einer geringen Ionenbeweglichkeit.
- Die Probe wird an der Grenzfläche zwischen Leit- und Folgeelektrolyt aufgegeben und muss eine Ionenbeweglichkeit besitzen, die zwischen diesen liegt.
- Alle Ionen wandern im elektrischen Feld mit der gleichen Geschwindigkeit, da kein homogener Grundelektrolyt den Stromtransport übernehmen kann.
- Da die Ionenbeweglichkeiten unterschiedlich sind, muss sich nach
- FORMEL
- die elektrische Feldstärke in den verschiedenen Zonen ändern. Aufgrund der sprunghaften Änderung der elektrischen Feldstärke an den Zonenrändern führt die Isotachophorese zu einer scharfen Zonentrennung.
- Die Wahl des Leit- und Folge-Ions erfolgt anhand der Ionenleitfähigkeiten der Probe. Die Leitfähigkeiten der Probe müssen zwischen denen des Leit- und des Folge-Ions liegen.
- Um die Grenzen der einzelnen Probenbestandteile besser erkennen zu können, können sogenannte Spacer-Ionen eingesetzt werden, deren Leitfähigkeiten zwischen denen der Probenbestandteile liegen.
- Die Isotachophorese wird meist zur Aufkonzentrierung von Proben verwendet (Probenfokussierung, sample stacking )
- Die Breite der erhaltenen Banden ist abhängig von der Teilchenanzahl des in der Bande vorliegenden Stoffs.
- Diskelektrophorese
- Die Diskelektrophorese ist eine Form der Gelelektrophorese, bei der man ein großporiges Sammelgel und ein engporiges Trenngel unterscheidet.
- Im Sammelgel findet eine Isotachophorese statt und im Trenngel eine normale Zonenelektrophorese.
- Beide Gele unterscheiden sich auch im pH-Wert (diskontinuierliches Puffersystem).
- Vorteil dieser Kombination ist die Konzentrierung der Probe im Sammelgel zu scharfen Startbanden.
- Isoelektrische Fokussierung
- Verfahren zur Bestimmung des isoelektrischen Punktes einer Substanz
- Die gesamte Trennstrecke weist einen pH-Gradienten auf. Dieser wird durch den Einsatz von amphoteren Polyaminocarbonsäuren als Gelbeimischung erreicht. Der pH-Gradient wird nun dadurch erreicht, dass im Anodenraum H+-Ionen, im Katodenraum OH--Ionen eingebracht werden und nun ein Strom angelegt wird. Die Ampholyte und Ionen beginnen durch das angelegte Feld im Gel zu wandern. Die Ampholyte bewirken nun an den Stellen, an denen sie sich im Gel einlagern einen bestimmten pH-Wert.
- Amphoteren Teilchen werden aufgrund ihrer unterschiedlichen isoelektrischen Punkte getrennt. Sie wandern bis in den Bereich, an dem der pH-Wert des Gels ihrem isoelektrischen Punkt entspricht. Dort bleiben sie liegen, da sie nun nach außen ungeladen sind und folglich die angelegte Spannung keinen Effekt mehr auf sie ausübt.
- Die Auswertung erfolgt entweder direkt mittels einer pH-Sonde oder indirekt mit Hilfe von Markersubstanzen.
- Die isoelektrische Fokussierung liefert sehr scharfe Zonen und ermöglicht die Erfassung von Differenzwerten im Bereich von 0,01 - 0,02 pH-Einheiten.
- SDS-Elektrophorese
- Trennung aufgrund der Masse der Moleküle
- Form der Gelelektrophorese, bei der die Probe mit SDS (Sodiumdodecylsulfate) inkubiert sind.
- Dieses zerstört die Quartärstruktur und es bilden sich negativ geladene Protein-SDS-Komplexe aus, die eine konstante Ladung pro Einheitsmasse besitzen und deshalb allein aufgrund ihrer Größe getrennt werden.
- Eine entscheidende Rolle für die Auftrennung spielt hier die Porengröße des Gels (restriktive Eigenschaft).
- Je kleiner der gebildete SDS-Komplex ist, desto schneller wandert der Komplex in Richtung Anode.
- Mit entsprechenden Markerproteinen kann man hiermit z.B. die Molmasse von Proteinen bestimmen.
Nachbearbeitung
- Fixierung
- Meist mit Methanol, Ethanol oder Essigsäure
- Sichtbarmachung
- Einfärbung
- Proteine, z.B. mit AgNO3 ("Silberfärbung"), "Chromassie Brilliantgrün R250" oder "Amidoschwarz"
- Aminosäuren, z.B. mit Ninhydrin
- RNA, z.B. mit Methylenblau oder Ethidiumbromid
- DNA, z.B. mit Ethidiumbromid
- Enzymreaktion
- Verschiedene spezifische Reagenzien
- Immunopräzipitation
- Antigen-Antikörper-Reaktionen
- Radioaktive Markierung
- Einfärbung
- Blotting-Verfahren
- Eluierung des Ergebnis aus dem Gel in eine Matrix, z.B. bei RNA- und DNA-Analysen verwendet
- Siehe auch:
