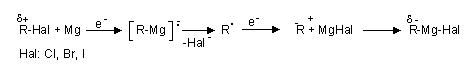Grignard-Reaktionen
Edukte und daraus folgende Produkte
- Aldehyde -> sekundäre Alkohole
- Alkine
-> Salz des Alkins
- Ar-MgX + C2H2 ----> Ar-H + MgX+ + C2H-
- Die Reaktion kann zum Beispiel zur Entfernung von Halogenen an aromatischen Systemen benutzt werden.
- MA 1-44
- Alkylhalogenide
-> Alkane
- R-X + Mg ----> R-MgX + H2O ----> R-H + MgX(OH)
- In wasserfreiem Ether wird das Alkylhalogenid mit Mg umgesetzt. Dabei setzt sich das Mg zwischen Alkylrest und Halogen. Durch Zusatz von Wasser (Protonenlieferant) wird MgCl durch H ersetzt und das Alkan entsteht. Das Nebenprodukt MgCl(OH) wird mit Hilfe von Salzsäure und unter Wasserabspaltung zu MgCl2 umgesetzt.
- RT 1-19
- Epoxide
-> prim. / sek. Alkohole
- Aus unsubstituierten Epoxiden (Oxiran), entstehen primäre Alkohole, aus substituierten sekundäre.
- RT x-125
- Ester
-> Ketone -> tertiäre Alkohole
- R-COOR --> R-CO-R --> R3COH
- Ester reagieren mit Grignard-Verbindungen zu Ketonen. Diese stehen jedoch in der Carbonylaktivitätsreihe vor den Estern, so dass die Reaktion auf der Stufe der Ketone nicht zu stoppen ist, sondern gleich der tert. Alkohol entsteht.
- RT x-125
- Formaldehyd -> primärer Alkohol
- Ketone
-> tertiäre Alkohole (-> Alkene)
- Reagenzien:
- H2O / H+ -> Alkene
- H2O / NH4Cl -> tert. Alkohole
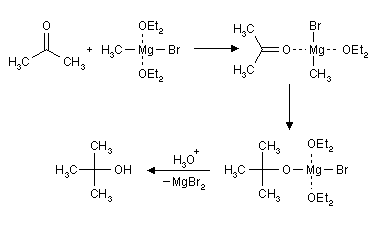
- Aus Ketonen und Alkylmagnesiumhalogeniden lassen sich tertiäre Alkohole darstellen.
- Werden diese sauer aufgearbeitet so entsteht unter Abspaltung von Wasser direkt das Alken, daher sollte zur Darstellung des tert. Alkohols nur mit NH4Cl / H2O aufgearbeitet werden.
- RT 1-56, x-125
- Reagenzien:
- Kohlendioxid
-> Carbonsäuren
- R-MgI + CO2 ----> R-COOMgI + H2O ----> R-COOH + MgI(OH)
- Durch Addition einer Grignardverbindung an CO2 wird nach der Aufarbeitung eine Carbonsäure erhalten, deren Gerüst um ein C-Atom vergrößert ist.
- RT 2-125ff
- Nitrile
-> Ketone
- Nitrile können mit Grignardverbindungen in Ketone überführt werden. Als Nebenprodukte bei der Hydrolyse entstehen MgI(OH) und NH3.
- RT 2-89
- tert. Amide -> Ketone
- tert. Formamide
-> Aldehyde
- R2N-CHO + MgI-R' --> R'-CHO
- Tertiäre Amide der Ameisensäure können durch Umsetzung mit Grignardverbindungen und anschließende Hydrolyse ins Halbaminal überführt werden. Dies zerfällt in ein sekundäres Amin und ein Aldehyd.
- Der Aldehyd besteht aus dem Rest der Grignardverbindung, der um eine Carbonylgruppe verlängert ist.
- RT 2-89
Reagenzien
- magnesiumorganische Verbindungen aus Magnesium und Alkylhalogeniden der Form R-MgX.
- Statt der Alkylhalogenide können auch verschiedene andere Stoffe eingesetzt werden, wie man an der obigen Liste erkennen kann.
- Reagenzien zur Aufarbeitung des magnesiumorganischen Zwischenprodukts sind meist Wasser und H+ oder NH4Cl
Bemerkungen
- Der Reaktionsverlauf bei Alkylhalogeniden entspricht einer nucleophilen Substitution an R'-Br mit R|- als Nucleophil. Andere Mechanismen, wie die Addition an polarisierte (aktivierte) Doppelbindungen sind bei anderen Stoffen ebenfalls möglich, so bei der Alkylierung polarer Mehrfachbindungen (v.a. Carbonylverbindungen).
- Innerhalb der magnesiumorganischen Verbindungen ist der Kohlenstoff negativ polarisiert (Umpolung).
- Das Reagens wird in Et2O hergestellt. Dieses stabilisiert die Verbindung, sonst beobachtet das Schlenk-Gleichgewicht.
- Carbonsäuren (bzw. deren Salze) setzen sich nicht mit dem Reagens um.
Reaktion
alternative Darstellung
Nebenreaktionen
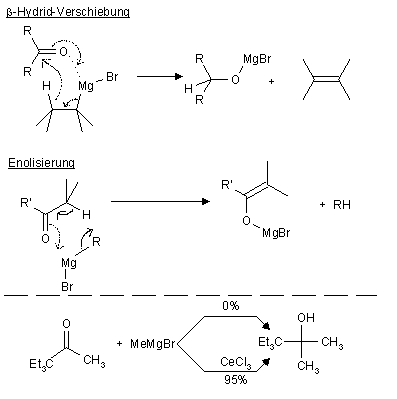
- Bei der Reaktion treten zwei Nebenreaktionen auf:
- β-Hydrid-Verschiebung
- Enolisierung (v.a. bei sterischer Hinderung)
- Das zweite Problem kann man "umgehen", indem man CeCl3 zugibt. Dabei entsteht wahrscheinlich eine cerorganische Verbindung die nur noch Nucleophil und nicht mehr basisch reagiert.
- Literatur:
- KM 206-210
- MT 549f, 556, 559, 700
- RT 1-22, 1-56, 1-78, x-124, 2-89, 2-128