Alkohole
Definition
- Verbindungen in denen eine OH-Gruppe an ein nichtaromatisches, gesättigtes C-Atom ohne weitere Heteroatome gebunden ist. Sitzt die OH-Gruppe an einem aromatischen C-Atom, so handelt es sich um ein
Phenol.
- Mehrwertige Alkohole besitzen mehrere OH-Gruppen an mehreren C-Atomen.
- Die Begriffe "ein-, zwei- oder mehrwertig" (Zahl der Hydroxylgruppen) dürfen nicht mit den Begriffen "primär, sekundär oder tertiär" (Art der Hydroxylgruppen) verwechselt werden!
- Die Reaktivität der Alkohole steigt von den primären zu den tertiären an. Benzyl- oder Allylalkohole reagieren wie tertiäre.
- Alkohole mit vicinalen Hydroxylgruppen werden Glykole
genannt (und auch dort abgehandelt).
Strukturmerkmal
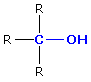
Reaktivität
- Die Acidität von Alkoholen beruht auf dem Proton der Hydroxylgruppe. Durch elektronenschiebende Reste wird die Acidität herabgesetzt, daher sind primäre Alkohole saurer als sekundäre oder tertiäre. Da
Alkohole im allgemeinen nur schwache Säuren sind, reagieren ihre Salze als starke Basen.
- Die Basizität von Alkoholen beruht auf den freien Elektronenpaaren des Sauerstoffs, das protoniert werden kann oder mit Lewis-Säuren
Komplexe bilden kann. Dabei sind tertiäre Alkohole basischer als sekundäre oder primäre.
Darstellung
- Oxidationsreaktionen
- Substitutionsreaktionen
- aus Halogenalkanen
- primäre Alkohole aus prim. Halogenalkanen und Hydroxidionen
- sekundäre Alkohole aus sek. Halogenalkanen und Hydroxidionen
- tertiäre Alkohole aus tert. Halogenalkanen und Acetationen, dann alkalische Hydrolyse
- aus primären aliphatischen Aminen
mit Salpetriger Säure
- Durch Salpetrige Säure wird das Amin diazotiert. Unter Abspaltung von N2 bleibt ein Carbeniumion zurück, das mit H2O zum Alkohol hydrolysiert wird.
- Produkte:
- primäre Alkohole aus prim. Aminogruppen an prim. C-Atomen
- sekundäre Alkohole aus prim. Aminogruppen an sek. C-Atomen
- Etherspaltung
- Reduktionsreaktionen
- Reduktion von Carbonylverbindungen
- Katalytische Hydrierung von Aldehyden und Ketonen
- primäre Alkohole aus Aldehyden und sowie Carbonsäurechloriden
- sekundäre Alkohole aus Ketonen
- Zink/Salzsäure
- primäre Alkohole aus Aldehyden
- sekundäre Alkohole aus Ketonen
- Zink/Natronlauge
- prim. Alkohole aus Aldehyden
- sek. Alkohole aus Ketonen
- Bouveault-Blanc-Reduktion
- prim. Alkohole aus Carbonsäureestern
- (prim. Alkohole aus Aldehyden)
- (sek. Alkohole aus Ketonen)
- Komplexe Hydride
- prim. Alkohole aus Aldehyden
- sek. Alkohole aus Ketonen
- Meerwein-Ponndorf-Verley-Reduktion
- prim. Alkohole aus Aldehyden
- sek. Alkohole aus Ketonen
- Cannizzaro-Reaktion
- prim. Alkohole aus Aldehyden
- Reduktionsreaktionen unter C-C-Verknüpfung
- Aldoladdition
- sek. Alkohole aus Aldehyden
- tert. Alkohole aus Ketonen
- Grignard-Reaktion
- mit Aldehyden, Formaldehyd, Ketonen
- prim. Alkohole aus Formaldehyd
- sek. Alkohole aus Aldehyden
- tert. Alkohole aus Ketonen
- Mit Estern (Carbon-, Ameisen-, Kohlensäureester, Lactone)
- sek. Alkohole aus Ameisensäureestern
- tert. Alkohole aus Carbonsäuren, Kohlensäureestern und Lactonen
- Mit Epoxiden
- prim. Alkohole aus Ethylenoxid
- sek. Alkohole aus substituierten Epoxiden
- Prins-Reaktion
- H2C=CH2 + HCHO --> HO-CH2-CH2-CH2-OH
Reaktionen
Nachweise
- durch Esterbildung mit 3,5-Dinitrobenzoylchlorid
- als Urethan mit Phenylisocyanat
- durch Umsetzung zum Alkylhalogenid und anschließender Reaktion mit Thioharnstoff
- durch Umsetzung mit KOH und CS2 zum Xanthogensäureester
|

