Ketone
Definition
- Die charakteristische Gruppe von Ketonen ist die polare Carbonylgruppe C=O. Diese lässt sich auch über die mesomere Grenzform C(+)-O(-) darstellen.
- Die Carbonylgruppe ist polarisiert, wobei der Kohlenstoff positiviert ist und damit leicht nucleophil angegriffen werden kann.
- Ketone tragen zu beiden Seiten der Carbonylgruppe einen Rest, der nicht Wasserstoff ist R-CO-R.
- Ketone können auch mehrere Carbonylgruppen enthalten, so z.B. in Diketonen oder Triketonen.
- Ketone sind weniger CH-acid als Aldehyde.
Strukturmerkmal
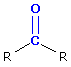
- Die Reste dürfen nicht H sein, da es sich sonst um ein Aldehyd
handeln würde.
Reaktivität
- Carbonylverbindungen mit Wasserstoff am a-C-Atom sind zur Keto-Enol-Tautomerie
in der Lage. Das bewegliche H-Atom und damit die Möglichkeit zur Anionbildung ist die Grundlage einer Reihe von Reaktionen von Carbonylverbindungen.
Darstellung
- Corey-Seebach-Methode
- Criegee-Oxidation
- Glykolspaltung
- Grignard-Reaktion mit Nitrilen
- Malaprade-Oxidation
- Oppenauer-Oxidation
- Oxidation aktivierter Methylgruppen
- Oxidation sekundärer Alkohole
- Ozonolyse
- Pinakolon-Umlagerung
- R1R2COH-CR3R4OH --> R2CO-CR1R3R4
- Swern-Oxidation
- Aliphatische Ketone
- Durch Alkylierung von Acetoessigester und anschließende Ketonspaltung.
- RT 2-93
- Reduktive Alkylierung von Carbonsäurederivaten
- u.U. weitere Alkylierung über das Keton hinaus zu tertiären Alkoholen
- RT 2-81
- Reaktion von Lithium-dialkylcupraten mit Carbonsäurechloriden
- Lithium-dialkylcuprate reagieren mit Carbonsäurechloriden zu Ketonen.
- Die Reaktion ist mit der Corey-House-Synthese zur Darstellung asymmetrischer Kohlenwasserstoffe vergleichbar.
- RT 2-89
- Hydrolyse geminaler Dihalogenide
- R-CX2-R --> R-CO-R
- Geminale Dihalogenide können durch konz. Schwefelsäure oder durch Alkalicarbonat zu Ketonen hydrolysiert werden.
- RT 2-85
- Aromatische Ketone
- Friedel-Crafts-Acylierung
- Ar-H + R-COX --> Ar-CO-R
- wichtigste Reaktion zur Darstellung
- Radikalische Halogenierung von Kohlenwasserstoffen zum geminalen Dihalogenid und anschließende Hydrolyse durch H2SO4. Die Halogenierung erfolgt fast ausschließlich am reaktiveren
benzylständigen C-Atom.
- RT 2-85f
- Phenolketone
- Cyclische Ketone durch:
- trockenes Erhitzen der Calcium- oder Bariumsalze von Dicarbonsäuren
- Durch Erhitzen gehen ein C-Atom und 3 Sauerstoffe als Erdalkalicarbonat aus der Dicarbonsäure. Dabei schließt sich der Ring zum cyclischen Keton, dessen Ring um ein C-Atom kleiner ist, als die
eingesetzte Dicarbonsäure.
- RT 1-88, 2-93
- Tiffeneau-Demjanoff-Ringumlagerung
- Symmetrische Ketone
- Durch trockenes Erhitzen der Erdalkalisalze von Carbonsäuren können unter Abspaltung von Calciumcarbonat symmetrische Ketone erzeugt werden.
- RT 2-93
- a-Hydroxyketone
Reaktionen
|

